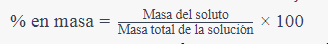La unidad de masa atomica, también conocida como «uma» o «u», es una medida fundamental en la física y la química que se utiliza para expresar la masa de partículas subatómicas y átomos. Esta unidad es esencial para comprender la estructura y la composición de la materia a nivel molecular y atómico.
La masa atómica se define en relación con la masa de un átomo de carbono-12, que se establece como exactamente igual a 12 unidades de masa atómica. Esta definición proporciona una base uniforme para comparar las masas de otros átomos y moléculas en la tabla periódica de elementos.

La unidad de masa atómica es fundamental para la química y la física moderna, ya que permite a los científicos calcular con precisión las proporciones y las masas de los elementos en diversas reacciones químicas y procesos nucleares.
En este contexto, exploraremos en detalle la importancia y el uso de la unidad de masa atómica en la comprensión de la estructura y la dinámica de la materia en el mundo subatómico.
¿Que es la unidad de masa atómica?
La unidad de masa atómica (uma), también conocida como unidad de masa atómica unificada (uma), es una unidad de medida utilizada en química y física para expresar las masas de átomos y moléculas de manera conveniente y comparativa.
La uma es fundamental para comprender la composición de la materia a nivel atómico y molecular. A continuación, se explican algunos aspectos clave sobre la unidad de masa atómica:
- Definición: La unidad de masa atómica se define en relación con la masa de un átomo de carbono-12 (^12C). Un átomo de carbono-12 se define como exactamente igual a 12 unidades de masa atómica. Esto significa que la uma proporciona una referencia estándar para la comparación de las masas de otros átomos y moléculas.
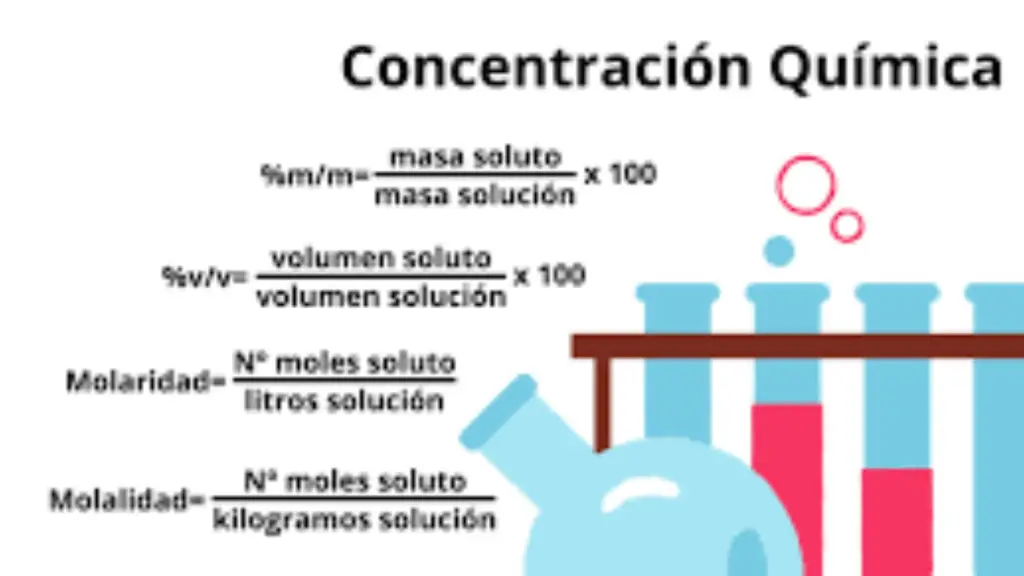
- Importancia: La uma es esencial en química porque permite expresar las masas atómicas y moleculares de los elementos y compuestos de manera más manejable en lugar de usar masas en gramos o kilogramos. Esto simplifica los cálculos y las comparaciones en química.
- Cálculo de la masa atómica de un elemento: Para calcular la masa atómica de un elemento, se promedia la masa de todos sus isótopos en relación con la uma. Esto se hace multiplicando la masa de cada isótopo por su abundancia relativa y sumando estos valores. Por ejemplo, la masa atómica del hidrógeno es aproximadamente 1.008 uma, ya que se tiene en cuenta la abundancia de los isótopos de hidrógeno.
- Utilidad en la tabla periódica: La tabla periódica de elementos muestra la masa atómica promedio de cada elemento expresada en uma. Esto permite a los químicos identificar fácilmente la relación de masas entre diferentes elementos y compuestos.
- Uso en química y física: La uma es crucial para realizar cálculos estequiométricos, determinar la estequiometría de reacciones químicas y comprender las relaciones de masa en procesos nucleares, como la fisión y la fusión nuclear.
En resumen, la unidad de masa atómica es una medida estándar que facilita la comparación de las masas de átomos y moléculas, y es esencial en química y física para comprender la composición y las reacciones de la materia a nivel subatómico.
¿Como calcular la masa atomica?
Para calcular la unidad masa atomica de un elemento químico, debes seguir estos pasos:
- Obtén la tabla periódica: Necesitas una tabla periódica actualizada. En ella, encontrarás la masa atómica promedio de cada elemento, generalmente expresada en unidades de masa atómica (uma) o, en algunos casos, en gramos por mol (g/mol).
- Encuentra el elemento: Ubica el elemento químico del que deseas calcular la masa atómica en la tabla periódica. Cada elemento está representado por su símbolo químico (por ejemplo, H para hidrógeno, O para oxígeno, C para carbono, etc.).
- Identifica los isótopos y sus abundancias: La mayoría de los elementos tienen varios isótopos, que son átomos del mismo elemento con un número diferente de neutrones en su núcleo. La masa atómica promedio toma en cuenta la contribución de todos los isótopos de un elemento y su abundancia relativa en la naturaleza. En la tabla periódica, a menudo se proporciona la masa atómica promedio para cada elemento.
- Calcula la masa atómica: Multiplica la masa de cada isótopo por su abundancia relativa en la naturaleza y luego suma estos valores. La fórmula general para calcular la masa atómica (MA) de un elemento es:MA = (M₁ * A₁ + M₂ * A₂ + … + Mn * An) / 100Donde:
- MA es la masa atómica del elemento.
- M₁, M₂, … Mn son las masas de los isótopos del elemento.
- A₁, A₂, … An son las abundancias relativas de los isótopos expresadas como porcentajes.
Por ejemplo, para calcular la masa atómica del carbono (^12C y ^13C) con una abundancia del 98.89% y 1.11%, respectivamente:
MA(C) = (12.0000 * 98.89 + 13.0034 * 1.11) / 100 = 12.011
La masa atómica del carbono es aproximadamente 12.011 uma.
Es importante destacar que, para la mayoría de los elementos, la masa atómica promedio en la tabla periódica ya está calculada y proporcionada.
Sin embargo, este proceso es útil si deseas calcular la masa atómica para elementos cuyas masas atómicas promedio no estén disponibles o si necesitas determinar la masa atómica de un compuesto químico específico a partir de las masas atómicas de los elementos que lo componen.