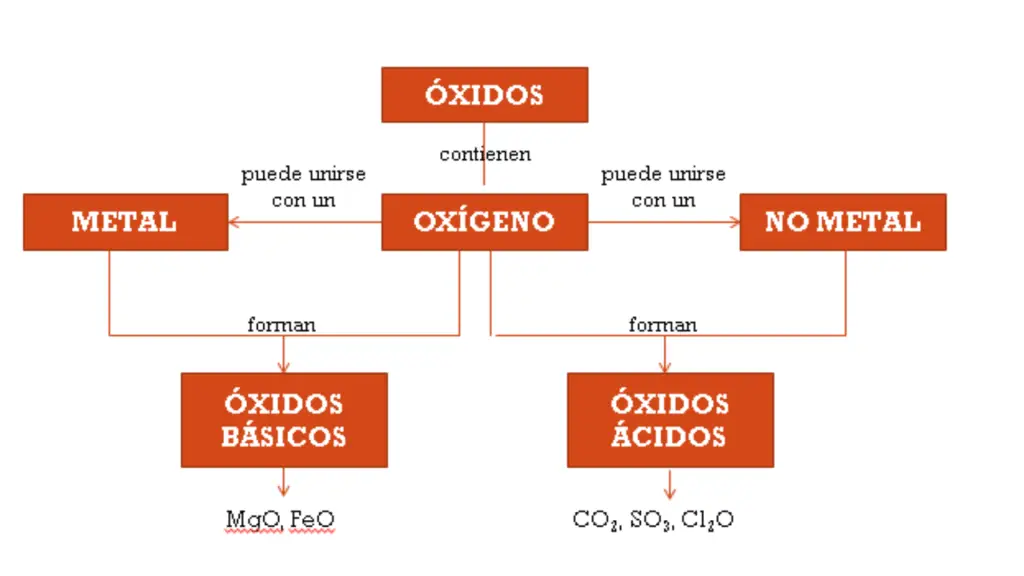
Los óxidos son compuestos químicos que contienen oxígeno combinado con otro elemento, que puede ser un metal o un no metal.
Óxidos básicos: estos óxidos se forman cuando un metal se combina con oxígeno. La nomenclatura se elabora utilizando el nombre del metal seguido de la palabra «óxido». Por ejemplo, el óxido formado por oxígeno y calcio se llama «óxido de calcio».
Óxidos o anhídridos ácidos: estos óxidos se forman cuando un no metal se combina con oxígeno. Por ejemplo, el dióxido de carbono es un óxido compuesto de oxígeno y carbono.
En este caso se utilizan las reglas de denominación de los óxidos ácidos y de los óxidos básicos en función de la proporción de oxígeno y se indican los elementos incluidos en su composición. Por ejemplo, el óxido de hierro (III) es un óxido mixto formado por oxígeno y hierro, donde se indica el estado de oxidación del hierro.
Ejemplos de nomenclatura química para óxidos.
Óxido de Sodio: Es un óxido básico formado por la combinación de sodio (Na) y oxígeno (O).
Monóxido de carbono (IV), también conocido como dióxido de carbono: es un óxido ácido formado por la combinación de carbono (C) y oxígeno (O) en una proporción de 1:2.

Óxido de hierro (III), también conocido como trióxido de hierro: es un óxido mixto que contiene hierro en estado de oxidación +3 y oxígeno.
Óxido de aluminio. Otro ejemplo de óxido básico. Este compuesto está formado a partir de aluminio (Al) y oxígeno (O).
Óxido de magnesio: este es otro óxido básico que se forma cuando el magnesio (Mg) reacciona con el oxígeno (O).
El óxido nítrico (II), también conocido como óxido nítrico: es un óxido ácido formado por la combinación de nitrógeno (N) y oxígeno (O) en una proporción de 1:1.
Óxido de silicio, también conocido como dióxido de silicio: este óxido es un componente importante de la arena y el cuarzo.
Óxido de plomo (IV), también conocido como dióxido de plomo: es un óxido ácido formado por la combinación de plomo (Pb) y oxígeno (O) en una proporción de 1:2.
La nomenclatura sigue las reglas mencionadas anteriormente, donde se utiliza el nombre del elemento, seguido de la palabra «óxido» o «dióxido» (en el caso de óxidos ácidos con dos átomos de oxígeno por átomo del otro elemento) y, en algunos En estos casos, se utiliza un número romano para indicar el estado de oxidación del elemento metálico.
