Las estructuras de Lewis, también conocidas como diagramas de Lewis o estructuras de puntos de Lewis, son representaciones gráficas de la disposición de los electrones en un átomo o molécula.
Fue hecho por el químico Lewis a principios del siglo XX y es una herramienta fundamental en química para comprender y predecir la formación de enlaces químicos y la geometría molecular.
Las estructuras de Lewis utilizan puntos (o, a veces, cruces) para representar electrones de valencia, que son electrones ubicados en la capa más externa de un átomo. Los electrones de valencia son responsables de formar enlaces químicos entre los átomos para estabilizarlos.
En estructuras de Lewis:Cada átomo está representado por su símbolo químico.Los electrones de valencia se representan como puntos alrededor del símbolo atómico.Los electrones primero se distribuyen como pares alrededor del átomo antes de emparejarse con otros electrones en enlaces químicos.Los puntos de Lewis se utilizan para mostrar cómo los átomos comparten electrones para formar enlaces covalentes (compartir electrones) o cómo los electrones se mueven de un átomo a otro en enlaces iónicos (transferencia de electrones).
El uso de estructuras de Lewis es muy útil para comprender la estructura y propiedades de las moléculas, así como para predecir la geometría molecular y la polaridad de las sustancias químicas. También se utiliza en la representación de iones y en la comprensión de reacciones químicas. Sin embargo, es importante señalar que las estructuras de Lewis son simplificaciones y no siempre reflejan con precisión la distribución de electrones en moléculas más complejas.
En algunos casos, se requiere el uso de técnicas químicas cuánticas más avanzadas para una descripción más precisa.
Ejemplo de estructura LEWIS
A continuación se muestran algunos ejemplos de estructuras de Lewis para varias moléculas e iones:
Molécula de agua (H2O):En una molécula de agua, el oxígeno (O) tiene 6 electrones de valencia y cada hidrógeno (H) tiene 1 electrón de valencia.Estructura de Lewis:

En esta estructura, los electrones de valencia se representan como puntos alrededor de los átomos de oxígeno e hidrógeno, y los pares de electrones no divididos del oxígeno se muestran como puntos no unidos.
Molécula de dióxido de carbono (CO2):
En el dióxido de carbono, el carbono (C) tiene 4 electrones de valencia y cada oxígeno (O) tiene 6 electrones de valencia.
Estructura de Lewis:
O=C=OEn esta estructura, los pares de electrones compartidos (en forma de líneas) se utilizan para representar el enlace covalente entre el carbono y el oxígeno.
Ión cloruro (Cl-):
El ion cloruro (Cl-) tiene un electrón extra en comparación con el átomo de cloro (Cl).Estructura de Lewis:Kl -En esta estructura, el ion cloruro se muestra con un electrón no compartido y una carga negativa (-) para indicar que ha ganado un electrón.
Molécula de amoníaco (NH3):
En la molécula de amoníaco, el nitrógeno (N) tiene 5 electrones de valencia y cada hidrógeno (H) tiene 1 electrón de valencia.Estructura de Lewis:
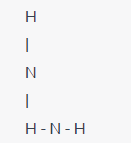
En esta estructura, los electrones de valencia se representan como puntos y los pares de electrones no compartidos en el nitrógeno se muestran como puntos no unidos.Estos son sólo algunos ejemplos de estructuras de Lewis para diversas moléculas e iones.
Las estructuras de Lewis son una herramienta valiosa para representar la disposición de los electrones en las moléculas y ayudar a comprender cómo se forman los enlaces químicos.

