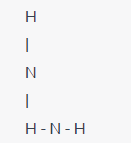La geometría molecular es una rama de la química que se ocupa de la disposición espacial de los átomos en una molécula.
Esta disposición tridimensional de los átomos de una molécula es fundamental para comprender muchas de sus propiedades químicas y físicas, así como su comportamiento en reacciones químicas.
La geometría molecular está determinada por la disposición de los átomos y los pares de electrones alrededor del átomo central de una molécula.
Los electrones alrededor de los átomos siguen ciertas reglas y distribuciones de energía que conducen a la formación de enlaces químicos e influyen en la forma en que los átomos se organizan en el espacio.

Las formas moleculares más comunes incluyen formas lineales, trigonales, tetraédricas, piramidales y planas.
La geometría molecular es importante para comprender cómo interactúan las moléculas entre sí, cómo se comportan en soluciones y cómo participan en reacciones químicas.
Además, la geometría molecular tiene una influencia significativa en las propiedades físicas y químicas de las sustancias, como su punto de ebullición, punto de fusión, polaridad y solubilidad. En resumen, la geometría molecular es una herramienta clave para comprender la química de las moléculas y su comportamiento en el mundo natural.
Ejemplos de geometría molecular
A continuación se muestran ejemplos de algunas geometrías moleculares comunes:
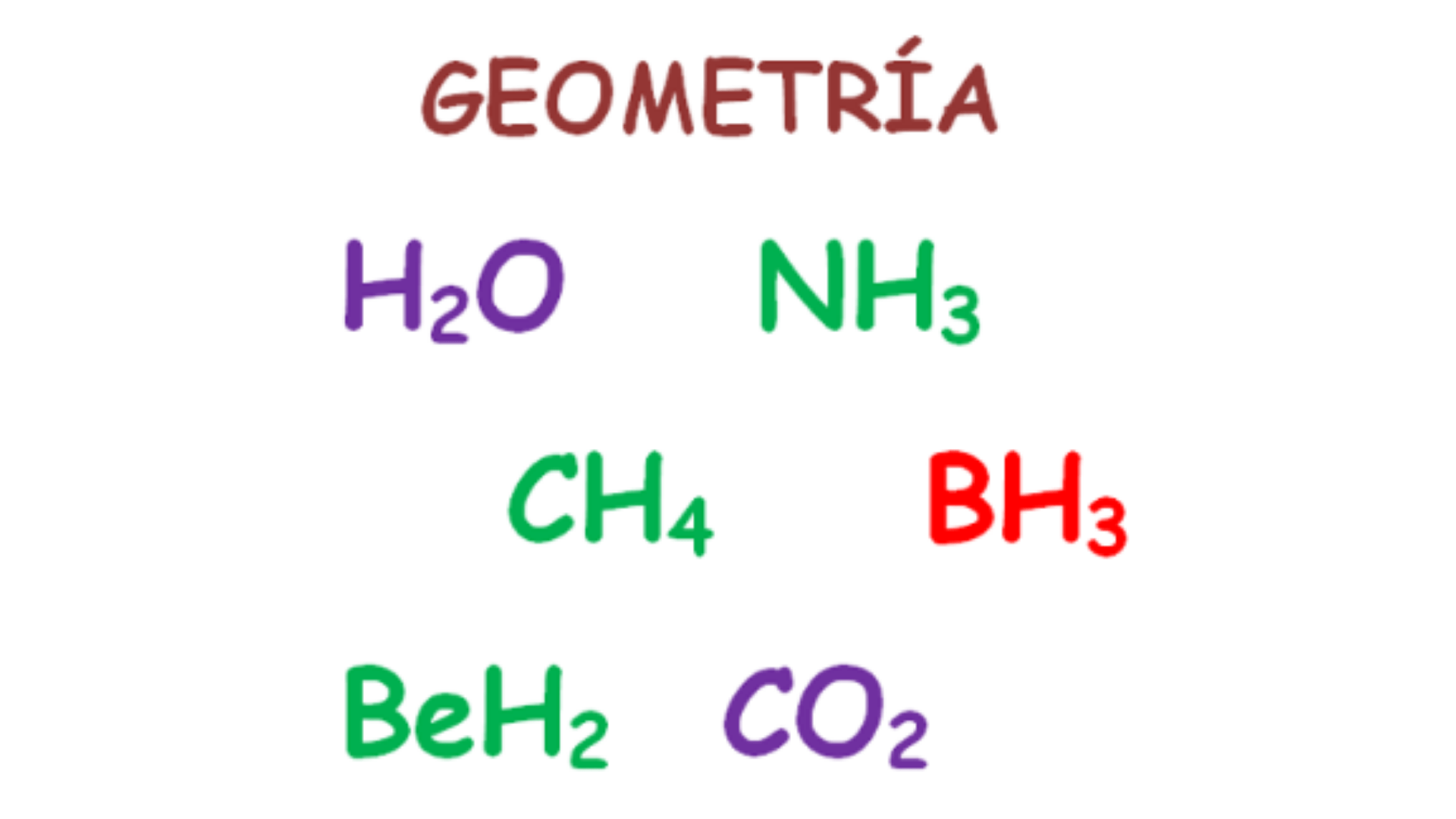
Lineal:
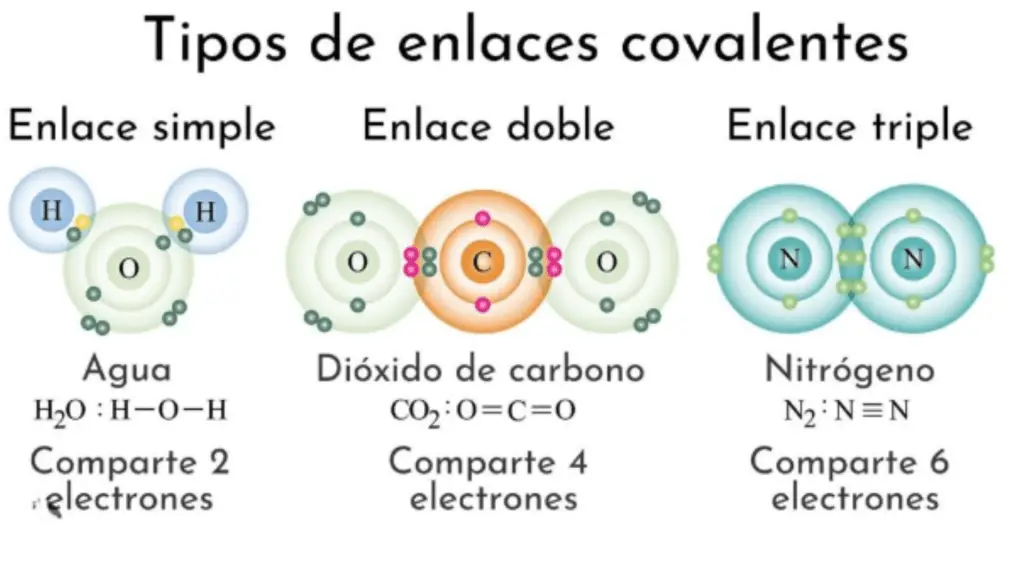
En una molécula lineal, los átomos forman una línea recta. Un ejemplo es la molécula de dióxido de carbono (CO2), donde los dos átomos de oxígeno están en lados opuestos del átomo de carbono central.
O=C=O
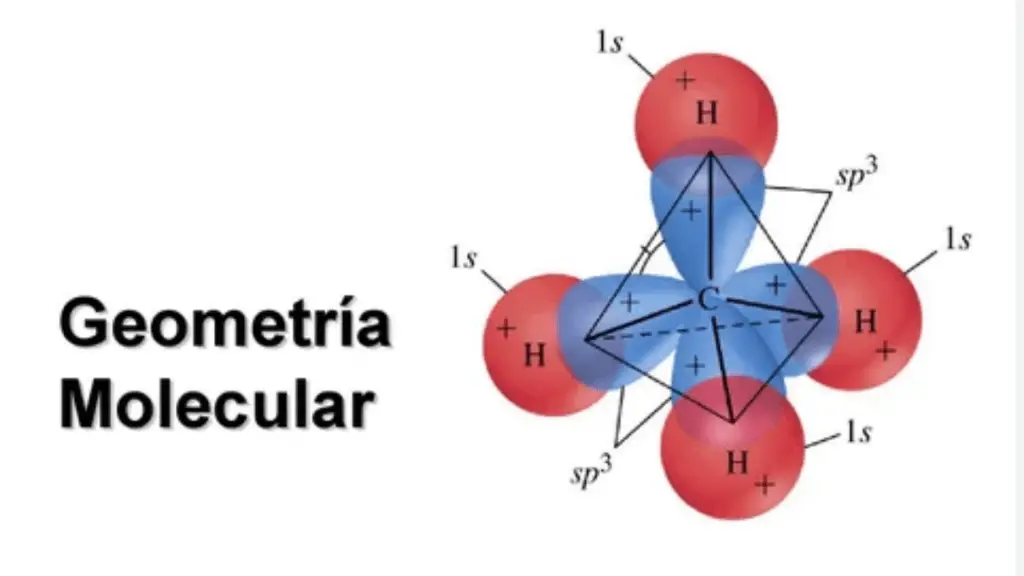
Tetraedro: En una geometría tetraédrica, un átomo central está en el centro de un tetraedro al que están unidos cuatro átomos o grupos de átomos. Un ejemplo es el metano (CH4).
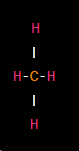
Plano trigonal: En esta geometría, los átomos o grupos de átomos alrededor del átomo central se encuentran en el mismo plano. Un ejemplo es la molécula de benceno (C6H6).

Piramidal: En una geometría piramidal, un átomo central tiene tres átomos o grupos de átomos en la base de una pirámide y un cuarto átomo o grupo en la parte superior. Un ejemplo es la molécula de amoníaco (NH3).
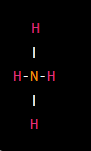
Angular o curvada: En una molécula cuadrada, los átomos o grupos de átomos están dispuestos en ángulo alrededor del átomo central. Una muestra es una molécula de H2O.
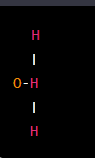
Octaedro:
En una geometría octaédrica, hay un átomo central en el centro de un octaedro y seis átomos o grupos de átomos en las esquinas del octaedro.
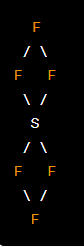
Un ejemplo es la molécula de hexafluoruro de azufre (SF6).
Estos son sólo algunos ejemplos de las muchas geometrías moleculares posibles que existen en química.
La geometría de una molécula está determinada por la disposición de los átomos y los pares de electrones alrededor del átomo central y tiene una influencia significativa en las propiedades y el comportamiento químico de la molécula.