La configuración electrónica es la distribución de electrones en los distintos niveles y subniveles de energía de un átomo.
En la tabla periódica, los elementos están ordenados según su número atómico, que corresponde al número de protones en el núcleo atómico.

La configuración electrónica de un elemento está representada por una notación especial que indica el número de electrones en cada nivel y subnivel de energía. A continuación se muestran algunos conceptos clave relacionados con la configuración electrónica y la tabla periódica:
Niveles de energía (capas):
Los electrones de un átomo ocupan diferentes niveles de energía. Estos niveles se representan con números enteros: 1, 2, 3, 4, etc. El nivel 1 está más cerca del núcleo y tiene menor energía, mientras que los niveles superiores están más alejados y tienen mayor energía.
Subniveles de energía:
Cada nivel de energía se divide en subniveles u orbitales, representados por las letras: s, p, d y f. Cada subnivel tiene un número específico de orbitales y puede contener un número diferente de electrones.
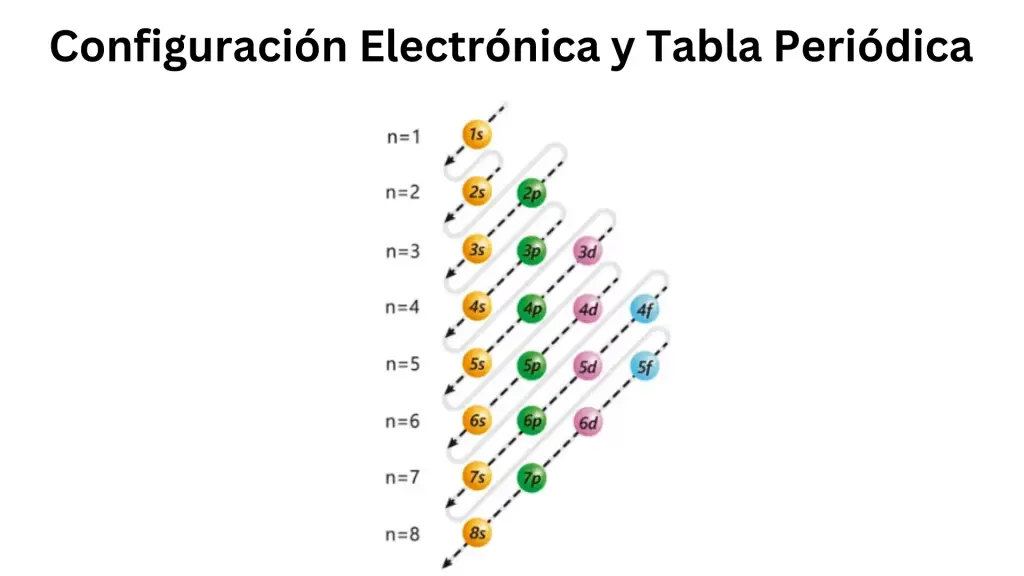
Regla de Aufbau:
Esta regla establece que los electrones llenan los niveles y subniveles de energía más bajos antes de pasar a los niveles y subniveles de energía más altos. El orden de llenado es 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, etc.
Principio de exclusión de Pauli:
Este principio establece que en un átomo, dos electrones en un orbital particular deben tener espines opuestos. Esto se representa como “ ↑↓” o como “arriba” y “abajo”.
Regla de Hund:
Esta regla establece que los electrones llenan los orbitales de un subnivel de tal manera que se maximiza el número de electrones con espines paralelos antes de que se emparejen en el mismo orbital.
Ejemplo de configuración electrónica:
La configuración electrónica del hidrógeno (H) es 1s^1, lo que significa que tiene un electrón en el nivel de energía 1s. La configuración electrónica del oxígeno (O) es 1s^2 2s^2 2p^4, lo que significa que tiene dos electrones en el nivel de energía 1s, dos en el nivel 2s y cuatro en el nivel 2p.
La tabla periódica es una herramienta útil para organizar elementos químicos en función de sus propiedades y estructura electrónica. Dentro de los elementos se ponen en filas horizontales llamadas períodos y llamados grupos en columnas verticales.
Los elementos de un mismo grupo tienden a tener propiedades químicas similares debido a la similitud de su configuración electrónica a nivel externo.
Es importante destacar que la configuración electrónica de un elemento está directamente relacionada con su posición en la tabla periódica y puede usarse para predecir sus propiedades químicas y su comportamiento en reacciones químicas.
Ejemplos de configuración electrónica y tabla periódica.
A continuación se muestran ejemplos de configuraciones electrónicas de algunos elementos y sus posiciones en la tabla periódica:
Hidrógeno (H): Configuración electrónica: 1s^1 Posición en la tabla periódica: el hidrógeno es el primer elemento de la tabla periódica y se encuentra en el grupo 1 (también conocido como grupo de metales alcalinos).
Helio (Él): Configuración electrónica: 1s^2 Posición en la tabla periódica: El helio pertenece al grupo 18 (grupo de gases nobles) y se encuentra en el periodo 1.
Carbono (C): Configuración electrónica: 1s^2 2s^2 2p^2 Posición en la tabla periódica: El carbono se encuentra en el grupo 14 y período 2.
Oxígeno (O): Configuración electrónica: 1s^2 2s^2 2p^4 Posición en la tabla periódica: El oxígeno se encuentra en el grupo 16 y período 2.
Hierro (Fe): Configuración electrónica: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6 Posición en la tabla periódica: el hierro se encuentra en el grupo 8 (también conocido como grupo del hierro) y en el período
Oro (Au): Configuración electrónica: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2 4f^14 5d^10 Posición en la tabla periódica: el oro se encuentra en el grupo 11 y en el período 6.
Estos son sólo algunos ejemplos de elementos y sus configuraciones electrónicas en la tabla periódica. Cada elemento tiene su propia configuración electrónica única, que determina sus propiedades químicas y su posición en la tabla periódica. La organización de los elementos en la tabla periódica se basa en patrones periódicos en sus configuraciones electrónicas, lo que permite predecir su comportamiento y propiedades químicas.

