El término «mol» es una unidad de medida en química que se utiliza para expresar la cantidad de sustancia en un sistema. Mole es una abreviatura de «mole» y su símbolo es «mole».
Esta unidad se introdujo como unidad básica en el Sistema Internacional de Unidades (SI) para representar cantidades de sustancias de manera consistente.Un mol de una sustancia contiene aproximadamente 6,022 x 10^23 entidades básicas, como átomos, moléculas o partículas.

Este número se conoce como número de Avogadro, en honor al científico italiano Amedeo Avogadro, quien hizo importantes contribuciones a la teoría molecular.
En términos más simples, un mol equivale a una docena, pero en lugar de representar 12 objetos, un mol representa una cantidad muy grande de partículas, equivalente al número de Avogadro. Por ejemplo, un mol de átomos de hidrógeno contiene aproximadamente 6,022 x 10^23 átomos de hidrógeno.
El concepto de mol es fundamental en química y se utiliza para realizar cálculos relacionados con la cantidad de sustancia, masa molecular y estequiometría en reacciones químicas.
Esto permite a los químicos trabajar con cantidades más manejables en lugar de lidiar con cantidades muy grandes cuando se trata de partículas individuales.
Ejemplo de cálculo de moles
A continuación se muestran algunos ejemplos de cálculos relacionados con moles en química:Calcular moles a partir de la masa: basándose en la masa de una sustancia y su masa molar, puedes calcular el número de moles usando la fórmula:
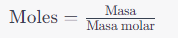
Por ejemplo, si tienes 18 gramos de agua (H2O), cuya masa molar es aproximadamente 18 gramos/mol, puedes calcular los moles de agua como:
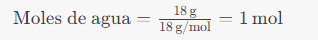
Esto significa que tienes 1 mol de agua en 18 gramos.Calcular la masa a partir de moles: si conoces el número de moles de una sustancia y su masa molar, puedes calcular la masa de una sustancia usando la fórmula:Masa=Moles×Masa molarPor ejemplo, si tienes 2 moles de dióxido de carbono (CO2) y la masa molar es aproximadamente 44 gramos/mol, puedes calcular la masa de CO2 como:Masa de CO2=2mol×44g/mol=88g

Entonces 2 moles de CO2 tienen una masa de 88 gramos.Contar moles en una reacción química: cuando realizas una reacción química, puedes calcular la cantidad de moles de reactivos o productos usando las proporciones estequiométricas de la ecuación química. Por ejemplo, en la reacción de combustión del metano (CH4) con oxígeno (O2) se forma dióxido de carbono (CO2) y agua (H2O):CH4+2O2→CO2+2H2O
Si tienes 2 moles de metano, puedes calcular cuántos moles de dióxido de carbono se formarán usando la ecuación de relación estequiométrica: 1 mol de CH4 produce 1 mol de CO2.
Por tanto, obtendrás 2 moles de CO2.Estos son sólo algunos ejemplos del uso de moles en cálculos químicos. El mol es una herramienta básica para medir la cantidad de sustancias en las reacciones químicas y en la química en general.