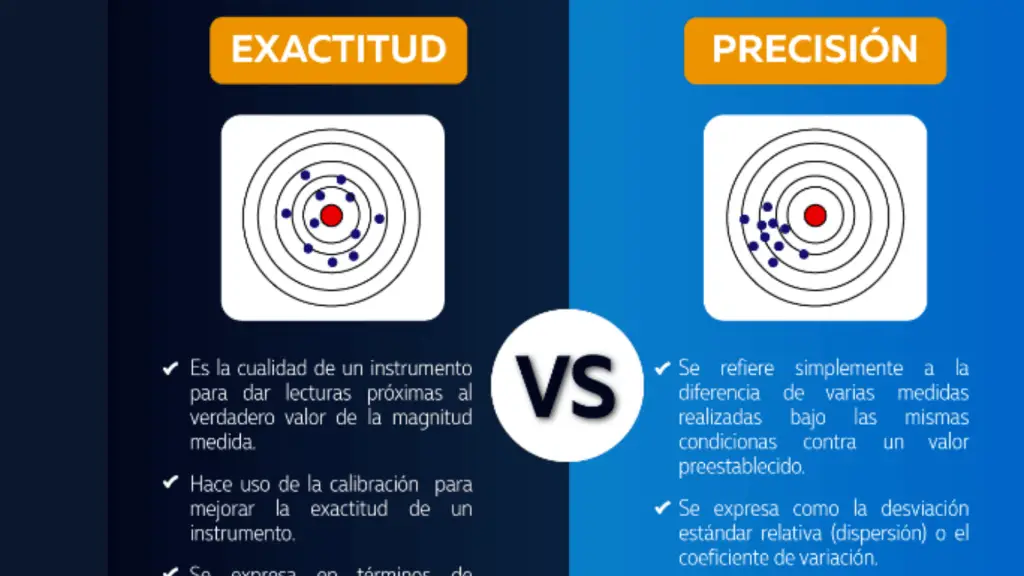
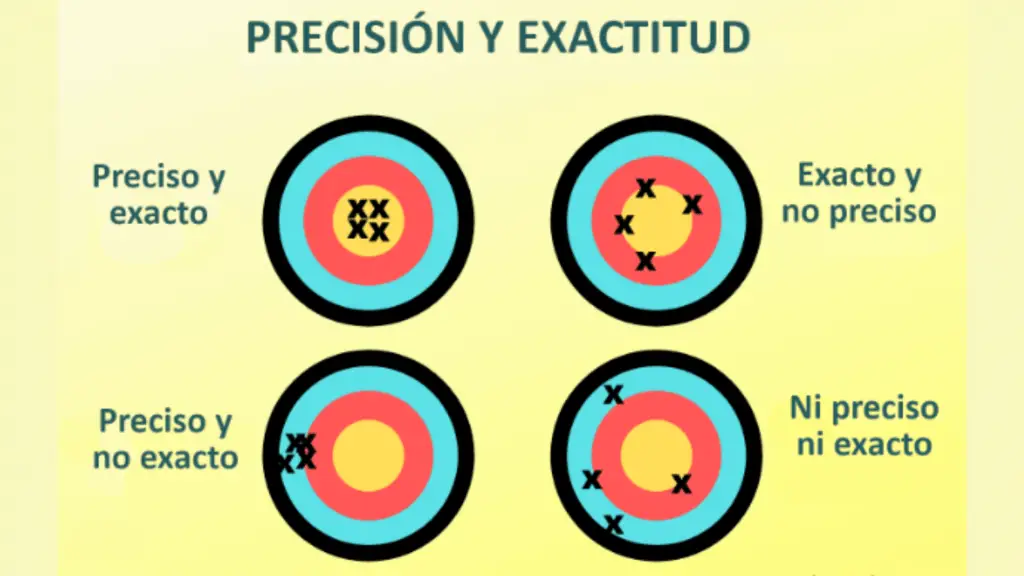
Los laboratorios de química suelen contener una amplia variedad de materiales y equipos diseñados para realizar experimentos químicos de forma segura y precisa. A continuación se enumeran algunos de los materiales y equipos más comunes que puede encontrar en un laboratorio de química:
1. Material de vidrio de laboratorio: Incluye tubos de ensayo, matraces, probetas, buretas, pipetas y vasos de precipitados, entre otros. La cristalería de laboratorio es resistente a la mayoría de los productos químicos y se utiliza para contener y medir líquidos.
2. Materiales plásticos: Algunos equipos y recipientes, como puntas de pipeta y frascos de almacenamiento, están hechos de plástico de alta calidad resistente a ciertos químicos.
3. Instrumentos de medición: Incluye balanzas analíticas, termómetros, cronómetros, pHmetros y otros dispositivos utilizados para medir masa, temperatura, tiempo, pH y otras propiedades.
4. Equipos de calefacción: Esto puede incluir mecheros Bunsen, placas eléctricas, estufas, hornos, autoclaves y otros dispositivos para calentar materiales.
5. Equipo de seguridad: Esto incluye gafas de seguridad, guantes, batas protectoras, ducha de seguridad y lavaojos para proteger a los investigadores de posibles peligros químicos.
6. Reactivos químicos: Productos químicos utilizados en experimentos, como ácidos, bases, disolventes, indicadores, sales y otros compuestos químicos.
7. Materiales de filtración: Embudos, papel de filtro y equipos de filtración utilizados para separar sólidos de líquidos.
8. Medición y movimiento de materiales: rejillas, espátulas, pinzas, buretas, pipetas y otros instrumentos utilizados para medir y mover productos químicos con precisión.
9. Instrumentos analíticos: Incluyen espectrofotómetros, cromatógrafos, espectrómetros de masas y otros equipos utilizados para analizar y caracterizar sustancias químicas.
10. Materiales de seguridad: Extintores, mantas ignífugas y otros equipos de seguridad contra incendios.
11. Equipos de destilación y evaporación: Destiladores, rotavapores y otros equipos utilizados para separar líquidos.
12. Material de vidrio adicional: Tubos capilares, tubos de centrífuga, tubos Nessler y otros recipientes de vidrio especiales.
13. Equipo de protección personal: además de gafas y guantes, también puede incluir bata de laboratorio, delantal y zapatos cerrados.
14. Equipos y software informáticos: Para registro de datos, análisis de resultados y control de instrumentos.
15. Productos de limpieza y desinfección: Soluciones de limpieza, detergentes, desinfectantes y otros productos para mantener el laboratorio limpio y seguro.
16. Almacenamiento de equipos: Gabinetes y estantes para mantener organizados y almacenados los productos químicos y los equipos.
¿Qué materiales se utilizan en un laboratorio de química escolar?
En los laboratorios de química de las universidades, los materiales y equipos tienden a ser más simples y seguros que los que se encuentran en los laboratorios de investigación más avanzados. A continuación se enumeran algunos materiales comunes utilizados en los laboratorios de química de las universidades:
1. Material de vidrio básico de laboratorio: Tubos de ensayo, matraces, probetas y vasos pequeños. Se utiliza para realizar experimentos básicos de medición y mezcla de sustancias.
2. Materiales plásticos: Se pueden utilizar recipientes de plástico como vasos de plástico, botellas de almacenamiento y pipetas de plástico desechables.
3. Herramientas básicas de medición: termómetro, cronómetro y regla para medir masa y longitud.
4. Equipo de seguridad personal: gafas de seguridad o protección para los ojos, guantes y ropa protectora para proteger a los estudiantes y al personal de posibles peligros químicos.
5. Materiales de filtración simples: Papel de filtro y embudo para realizar experimentos de filtración básicos.
6. Medición y movimiento de materiales: Rejillas, espátulas y pinzas para medir y mover productos químicos.
7. Reactivos químicos básicos: Ácidos y bases diluidos, sales y otros químicos utilizados en experimentos a nivel escolar.
8. Equipo básico de calefacción: Mechero Bunsen o pequeña placa calefactora para producir calor controlado.
9. Productos de limpieza y desinfección: Soluciones de limpieza suaves y desinfectantes para mantener limpias las áreas de trabajo.
10. Equipo básico de seguridad: Extintores y duchas de seguridad, aunque en la mayoría de laboratorios escolares estos elementos son menos comunes que en laboratorios más avanzados.
11. Material de escritura y cuadernos de laboratorio: Cuadernos de laboratorio, lápices, bolígrafos y papel para anotar observaciones y resultados.
12. Equipos y software de cómputo: Podrán existir computadoras con software especial para realizar análisis de datos y registrar resultados.
¿Qué puedo aprender en el Laboratorio de Química del colegio?
En los laboratorios de química de las universidades, los estudiantes pueden aprender una variedad de conceptos y habilidades básicos relacionados con la química. A continuación se detallan algunos conocimientos y habilidades que se pueden obtener en el laboratorio de química de una escuela:
1. Conceptos básicos de la química: los estudiantes pueden aprender los principios básicos de la química, como la estructura de la materia, los átomos y las moléculas, los elementos y compuestos químicos.
2. Medida y unidades: Aprenden a medir con precisión utilizando instrumentos como tubos de ensayo, buretas y básculas, además de comprender las unidades de medida utilizadas en química, como gramos, litros y moles.
3. Reacciones químicas: Observan y realizan experimentos para comprender cómo ocurren las reacciones químicas, incluida la formación de nuevos compuestos y cambios en las propiedades de una sustancia.
4. Seguridad en el laboratorio: aprenden prácticas de seguridad importantes en un entorno de laboratorio, incluido el uso de gafas y guantes de seguridad y cómo responder a situaciones de emergencia.
5. Técnicas de laboratorio: Adquieren habilidades en técnicas de laboratorio como preparación de soluciones, filtración, destilación y valoración.
6. Manejo de reactivos químicos: Aprenden a manejar reactivos químicos de manera segura y correcta, incluidos ácidos, bases y otros químicos comunes.
7. Análisis de datos: aprenden a recopilar datos experimentales, registrar observaciones y realizar cálculos para analizar resultados experimentales.
8. Interpretación de resultados: entienden cómo interpretar los resultados experimentales y sacar conclusiones basadas en la evidencia recopilada.
9. Resolución de problemas: Desarrollan la capacidad de plantear y resolver problemas relacionados con la química, aplicando los conocimientos adquiridos en el laboratorio.
10. Trabajo en equipo: los experimentos suelen realizarse en grupos, lo que fomenta la colaboración y el trabajo en equipo entre los estudiantes.
11. Habilidades de comunicación: Aprenden a comunicar sus observaciones y resultados de forma clara y eficaz, a menudo a través de informes y presentaciones de laboratorio.
12. Aplicación de la química en la vida cotidiana: Muestra cómo se pueden aplicar conceptos químicos en la vida cotidiana, desde la cocina hasta la medicina y la industria.
En resumen, un laboratorio de química universitario es un lugar donde los estudiantes pueden experimentar directamente conceptos y principios químicos, adquirir habilidades técnicas y de resolución de problemas y desarrollar una comprensión más profunda de la química y su relevancia en el mundo real. Esta experiencia práctica es fundamental para la educación científica y prepara a los estudiantes para estudios adicionales en química u otras disciplinas relacionadas.