Los enlaces simples, dobles y triples se refieren al número de enlaces químicos que un átomo puede formar con otros átomos en una molécula.
Estos enlaces se basan en el intercambio y la compartición de electrones entre átomos para formar una estructura molecular estable. Aquí encontrará una descripción de los tipos de enlaces individuales y sus diferencias:

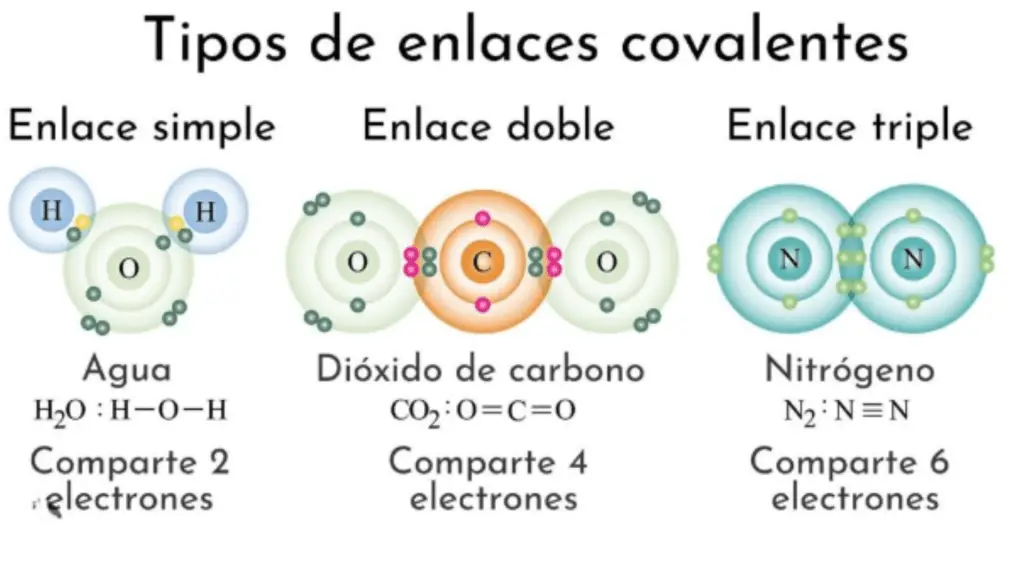
Enlace sencillo:
Un enlace simple se forma cuando dos átomos comparten un par de electrones.
Es el tipo de conexión más común y débil.
Está representado por una sola línea entre los átomos en una fórmula química.
Ejemplo: el enlace entre dos átomos de hidrógeno en una molécula de H2 es un enlace simple. S.S.
Doble enlace:
Un doble enlace se forma cuando dos átomos comparten dos pares de electrones (cuatro electrones en total).
Es más fuerte que un vínculo simple.
Está representado por una doble línea entre los átomos en una fórmula química.
Ejemplo: El enlace entre dos átomos de carbono en una molécula de eteno (C2H4) es un doble enlace. H2C=CH2.
Triple enlace:
Un triple enlace se forma cuando dos átomos comparten tres pares de electrones (seis electrones en total).
Es más fuerte que un enlace doble y mucho más fuerte que un enlace simple.
Está representado por una línea triple entre los átomos en una fórmula química.
Ejemplo: El enlace entre dos átomos de nitrógeno en una molécula de gas nitrógeno (N2) es un triple enlace. norte≡norte.
La principal diferencia entre estos enlaces es el número de electrones compartidos y, por tanto, la fuerza del enlace.
A medida que aumenta el número de electrones compartidos, el enlace se vuelve más fuerte y más corto, afectando las propiedades químicas y físicas de la molécula.
Los enlaces dobles y triples son más comunes en los compuestos orgánicos y los átomos de carbono y de hidrógeno a menudo forman dichos enlaces para lograr una estructura molecular estable.
Ejemplos de enlace simple, doble y triple.
Enlace sencillo:
Ejemplo: molécula de agua (H2O)
Fórmula química: H-O-H
En esta molécula, cada átomo de hidrógeno comparte un único par de electrones con el átomo de oxígeno, formando enlaces simples.
Enlace duplicado:
Ejemplo: eteno o etileno (C2H4)
Fórmula química: H2C=CH2
En el eteno, los dos átomos de carbono comparten dos pares de electrones, formando un doble enlace entre ellos. Cada átomo de carbono está unido a dos átomos de hidrógeno.
Triple enlace:
Ejemplo: nitrógeno molecular (N2)
Fórmula química: N≡N
En el nitrógeno molecular, los dos átomos de nitrógeno comparten tres pares de electrones, formando entre ellos un triple enlace extremadamente fuerte. Esto es característico de las moléculas diatómicas de gas nitrógeno en la atmósfera.
