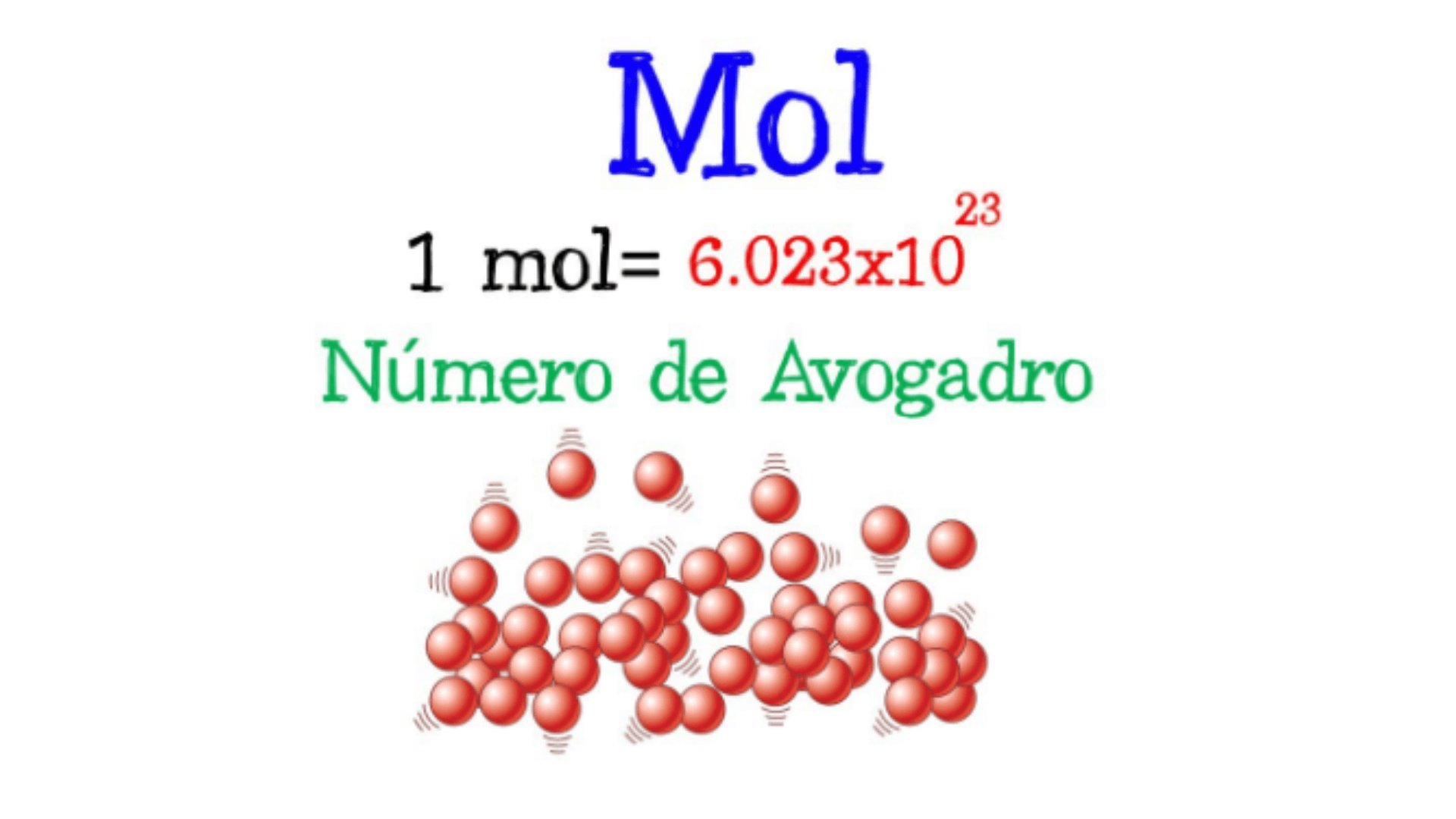
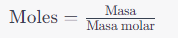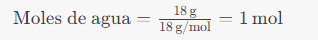Nombrar compuestos químicos es crucial en química para transmitir con precisión la composición y estructura de las sustancias. Se utilizan reglas y nomenclatura específicas para nombrar compuestos según el tipo de compuesto.
A continuación proporciono algunas pautas generales para nombrar compuestos químicos:
Compuestos iónicos (sales):
Los cationes (iones cargados positivamente) llevan su nombre.Los aniones (iones cargados negativamente) se nombran cambiando la terminación del nombre del elemento por el sufijo «-ide» o «-ite», dependiendo de si tiene carga fija o variable, tal es el caso que cloruro de sodio se llama a NaCl.
Compuestos moleculares (covalentes):
Los prefijos numéricos se utilizan para indicar el número de átomos de cada elemento en la molécula, excepto el primer elemento cuando solo hay uno.
El segundo elemento se nombra con el sufijo “-uro”.Ejemplificando que el dióxido de carbono se denomina CO2.
Ácidos:Los ácidos binarios (que contienen hidrógeno y otro elemento) se nombran con el prefijo «ácido», seguido del nombre del segundo elemento, que termina en «-hídrico».Los oxoácidos (que contienen hidrógeno, oxígeno y otro elemento) se denominan según ciertas reglas que varían según la cantidad de oxígeno en la molécula.

Hidrocarburos: Los hidrocarburos alifáticos (sin anillos) se nombran con prefijos para indicar el número de átomos de carbono y sufijos para indicar el tipo de enlace (-ano,-eno y -ino para enlaces simples, dobles y triples respectivamente).
Ejemplo: el CH4 se llama metano.
Compuestos orgánicos con grupos funcionales:
En los compuestos orgánicos, los grupos funcionales (por ejemplo, alcoholes, aldehídos, cetonas, ácidos carboxílicos, etc.) se denominan según su estructura y se incorporan al nombre principal del compuesto.
Compuestos inorgánicos complejos:
Los compuestos inorgánicos complejos como las coordenadas y los compuestos de coordinación tienen sistemas de nomenclatura específicos basados en la estructura y carga de los iones presentes.
Es importante tener en cuenta que estas son sólo pautas generales y que existen reglas más detalladas y específicas para cada tipo de conexión. Por tanto, es importante consultar las reglas de nomenclatura de la química orgánica e inorgánica para nombrar compuestos de forma precisa y adecuada.
Ejemplos de denominación de compuestos químicos.

Claro, aquí hay algunos ejemplos de cómo nombrar compuestos químicos usando reglas de nomenclatura:
Cloruro de sodio (NaCl):
En este caso, «Na» es el símbolo del sodio y «Cl» es el símbolo del cloro. Para nombrar el compuesto, tomamos el nombre del catión (sodio) y luego el nombre del anión (cloro), cambiando la terminación “-ido” de cloro.
Dióxido de carbono (CO2):
El “CO2” contiene dos átomos de oxígeno y un átomo de carbono. Para nombrar el compuesto utilizamos el prefijo “di-” para indicar que hay dos átomos de oxígeno y luego nombramos el segundo elemento, carbono, sin cambiar su nombre.
Ácido clorhídrico (HCl):
Este es un ácido binario que contiene hidrógeno (H) y cloro (Cl).
El nombre se da con el prefijo “ácido” seguido del nombre del segundo elemento con la terminación “-hídrico”.
Metano (CH4):
El metano es un hidrocarburo alifático con un solo átomo de carbono y cuatro átomos de hidrógeno.
La denominación sigue al nombre del elemento principal (carbono) y el prefijo «met-» para indicar un solo átomo de carbono.
Etileno (C2H4):
El etileno es un hidrocarburo alifático con dos átomos de carbono y cuatro átomos de hidrógeno. El nombre tiene el prefijo “et-” para indicar dos átomos de carbono y el sufijo “-eno” para indicar que existe un doble enlace entre los átomos de carbono.
Ácido acético (CH3COOH):
El ácido acético es un ácido carboxílico con una estructura más compleja. La denominación tiene en cuenta el grupo funcional “-COOH” y se utiliza el prefijo “ácido” seguido del nombre de la cadena carbonada principal.
Estos son sólo algunos ejemplos de cómo nombrar compuestos químicos utilizando reglas de nomenclatura. La nomenclatura puede volverse más compleja a medida que se trabaja con compuestos químicos más grandes y grupos funcionales adicionales.